Schadet Cannabis dem Gehirn?
Inhaltsverzeichnis
Cannabis und das Gehirn. Zwei komplexe Systeme treffen auf einander. Kann Cannabis dem Gehirn wirklich schaden? Wenn ja, welche Folgen sind von Cannabis auf das Gehirn sind zu erwarten? Alles über die Interaktion von Cannabis und dem Gehirn und deren Auswirkungen erfahren Sie in folgendem Artikel.
BEEINTRÄCHTIGUNG DES GEHIRNS DURCH CANNABIS?
Kurzfristige Effekte auf Gehirn und Gedächtnis
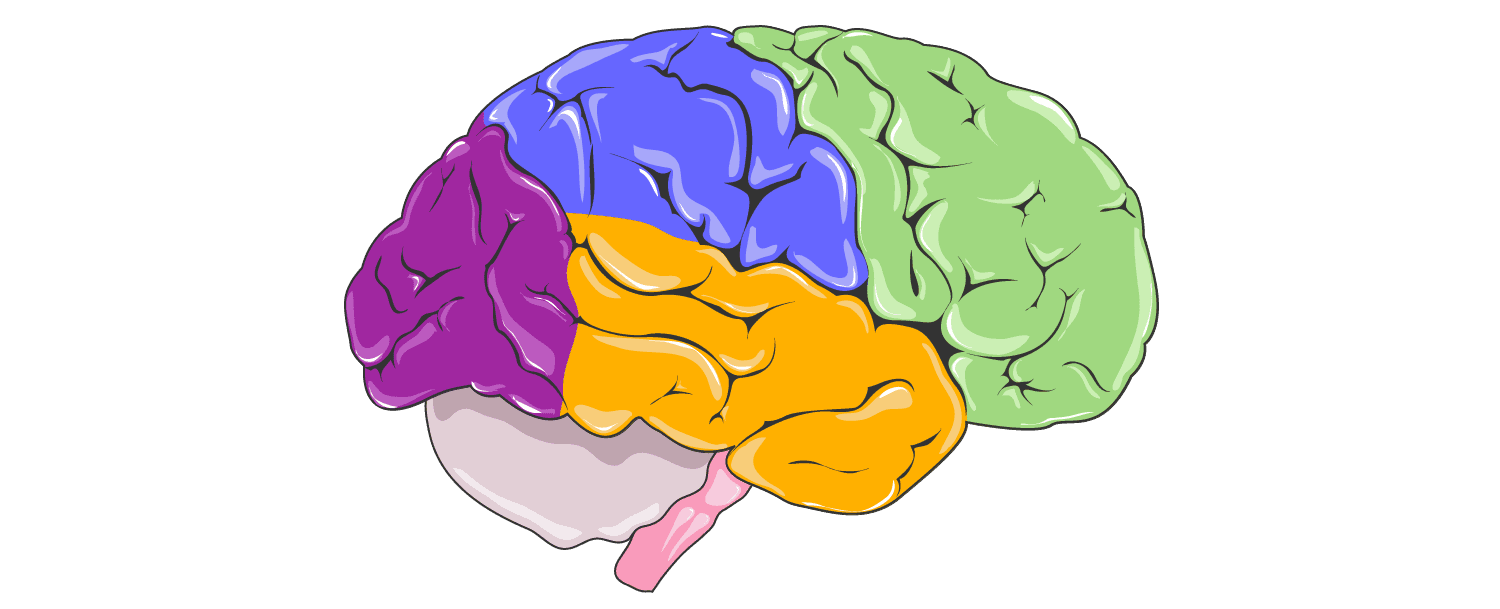
Durch die Beeinflussung verschiedener Gehirnregionen durch Cannabis wird die Leistung des Gehirns verschlechtert. Das Gedächtnis, die Aufmerksamkeit und der motorische Apparat werden nach dem Cannabis Konsum leicht geschwächt.⁴⁴ ⁴⁵Dieser Effekt hält meist bis zu mehreren Stunden nach dem Gebrauch an und ist spätestens nach 72 Stunden beendet.⁴⁶ ⁴⁷
Von dem direkten Einfluss von Cannabis auf das Gehirn, sind vor allem das Arbeits- und Kurzzeitgedächtnis betroffen.⁴⁴ ⁴⁵ ⁴⁸ ⁴⁹ Dadurch können Nutzer kurzfristig Dinge vergessen, die erst vor wenigen Minuten oder sogar Sekunden stattfanden. Das verschlechterte Gedächtnis wirkt sich zudem negativ auf die Leistung beim Arbeiten aus. Man ist weniger produktiv und lässt sich leicht vom Thema ablenken.
Langzeitfolgen?
Nachdem die psychotrope Wirkung von Cannabis auf das Gehirn nachgelassen hat, kann die Gehirnleistung immer noch beeinträchtigt sein. Der Grad der Beeinträchtigung hängt von der Menge und dem Konsummuster ab.⁵⁰ In extremen Fällen können Nebenwirkungen auch noch an den nachfolgenden Tagen auftreten. Letztendlich haben jedoch diese Auswirkungen nach aktueller Auffassung keine bleibenden Langzeitfolgen auf das Gehirn! ⁴⁸ ⁵¹ ⁵²
ALLGEMEINE EFFEKTE VON CANNABIS AUF DAS GEHIRN
THC induzierte Effekte
Cannabis ist auf der ganzen Welt für seine psychoaktiven Eigenschaften bekannt. Bisher sind im Gehirn hauptsächlich Cannabinoid Rezeptoren von Typ 1 (CB1) erforscht worden.¹ Diese sind auch für die meisten psychoaktiven Einflüsse auf das Bewusstsein verantwortlich. In der Gehirnregion des Hypothalamus führt der Konsum von Cannabis zur Ausschüttung des Hormons Ghrelin ², das einen appetitanregenden Effekt besitzt.³ ⁴ Des Weiteren hat es positive Effekte gegen Übelkeit und Erbrechen, insbesondere bei Chemotherapie-induziertem Erbrechen.⁵⁻⁷ Cannabis regt wiederum über Interaktion mit dem CB1-Rezeptor den Blutfluss im anterioren cingulären Kortex an. Dies ist ein funktioneller Teil des Gehirns.⁸⁻¹⁰ Dieses ist hat starke Auswirkungen auf den Kreislauf. Als Folge dieser Aktivierung, erhöht sich Herzrate und Blutdruck.¹¹⁻¹⁴Auch Schwindel oder Benommenheit können durch eine Auswirkung auf den Blutfluss des Gehirns, in Form einer orthostatischen Dysregulation, auftreten.
Dieser Effekt ist jedoch nach Toleranzentwicklung nicht mehr zu beobachten.¹⁵⁻¹⁸ Zusätzlich hat Cannabis schmerzlindernde Effekte auf chronische und neuropathische Schmerzen¹⁹ ²⁰, insbesondere bei HIV-Patienten²¹ ²² oder multiple Sklerose-Patienten.²³⁻²⁸ Auch bei tumorbedingten Schmerzen konnten Cannabis-Medikamente eine Besserung erzielen. Vor allem in Kombination mit einem weiteren Schmerzmittel.¹¹³⁻¹²³ Wobei THC allein für manche chronische Schmerzen keine Besserung der Schmerzsymptomatik verursacht hat.²⁰ Manchmal scheinen die Nebenwirkungen von Cannabis die positiven Effekte aufzuwiegen, so dass der Benefit für manche Patienten fraglich ist.²⁹ Für eine Behandlung von postoperativen akuten Schmerzen oder andere Arten von Schmerz hat Cannabis eher wenig nennenswert positive Auswirkungen.²⁹ Insgesamt braucht es noch mehr qualitativ hochwertige Studien, um das Nutzen-Risiko-Verhältnis besser zu definieren, als auch um die Effizienz von Cannabis als Schmerzmittel zu untermauern.
CBD induzierte Effekte
Allem Anschein nach kann in Cannabis enthaltendes CBD durch Interaktionen mit dem Gehirn und dem Rückenmark potentiell schmerzlindernde³⁰⁻³⁶, angstlösende³⁷⁻⁴⁰ und entzündungshemmende⁴¹ ⁴² Effekte hervorrufen. Außerdem kann es die Bindungsstellen von THC blockieren, weshalb die psychotropen Wirkungen von THC teilweise vermindert werden können.⁴³ Es braucht aber weitere klinische Studien um den Nutzen definitiv zu bestätigen, besonders die schmerzlindernden Eigenschaften müssen näher differenziert werden. Gerade die Wirkung auf Schmerz besitzt eine extrem dünne Datenlage, weshalb diese Information mit Vorsicht genossen werden muss.
AUSWIRKUNGEN VON CANNABIS AUF DIE PSYCHE
Auswirkungen auf die Kreativität
Die Auswirkungen auf die Psyche sind so unterschiedlich wie der Mensch selbst. Jedoch gibt es Daten die gewisse Schlussfolgerungen zu lassen. So konnte bei Cannabis keine positiven Auswirkungen auf die Kreativität festgestellt werden. Bei höheren Dosen kann Cannabis sogar die Kreativität verschlechtern.⁵³
Antriebslosigkeit?
Als Folge der psychotropen Wirkung von Cannabis auf das Gehirn, kann sich ebenso eine Antriebslosigkeit. Der Grund darin liegt vermutlich in der geringeren Synthese von Dopamin, die sich oftmals auch bei chronischen Nutzern, in einem Mangel an Motivation äußert.⁵⁴ ⁵⁵ Zusätzlich ist eine Konzentrationsschwäche möglich.⁴⁴
Schlafqualität bei Cannabiskonsum?
Bei den Wirkungen auf die Schlafqualität muss man wiederum zwischen im Cannabis enthaltenem CBD und THC unterscheiden. THC scheint nur kurzfristige positiv auf den Schlaf zu wirken. Bei Dauerkonsum wird auf Grund der Toleranzentwicklung kein Effekt mehr erzielt und die Schlafqualität scheint sich eher zu verschlechtern. Wohingegen CBD deutliche Hinweise zeigt dauerhaft die Schlafqualität verbessern zu können und nun auch bei Schlafstörungen erprobt wird.⁵⁶
Cannabis bei Angststörungen
Bei einem dauerhaftem Cannabis Konsum, scheint das Risiko Angst- oder Paniksymptome zu entwickeln ca. doppelt so hoch zu sein.⁵⁷ CBD hingegen scheint wieder gegensätzlich zu Cannabis zu arbeiten und eher eine angstlösende Wirkung einzunehmen.³⁷⁻⁴⁰

Risiken für weitere psychische Krankheiten
Weitere betroffene Krankheitsbilder sind Depression, Schizophrenie und Psychosen. Die Auswirkungen von Cannabis auf diese Krankheiten sind stark diskutiert und sehr kontrovers.
So deuten einige Ergebnisse daraufhin, dass langfristiger Marihuanakonsum im Vergleich zu Nichtkonsumenten offenbar nicht oder nur sehr leicht (bei jungen Erwachsenen) mit einem erhöhten Langzeitrisiko für die Entwicklung depressiver Symptome verbunden ist.⁵⁸⁻⁶¹ Auf Grund unzureichender Daten können aktuell keine positive Auswirkungen auf eine schon bestehende Depressionen aufgeführt werden.⁶² Zwar wurde sehr schwache positive Effekte festgestellt⁶³, jedoch scheint Cannabis bei genauerer Betrachtung die Symptome einer Depression sogar zu verschlimmern.⁶² Soziales Umfeld oder anderer Drogenkonsum, spielen scheinbar auch eine wichtige Rolle und deshalb ist die Auswirkung stark von der Person selbst abhängig.
Psychosen und Schizophrenie?
Schizophrenie und Psychosen liefern hier etwas mehr Daten. Aktuell ist nicht eindeutig klar, ob ein direkter kausaler Zusammenhang zwischen Cannabiskonsum und Schizophrenie bzw. Psychosen gezogen werden kann. Manche Quellen beschreiben einen direkten Zusammenhang⁶² ⁶⁴⁻⁷² andere behaupten eine vorbestehende psychologische Krankheit, wie Schizophrenie, werde dadurch verstärkt.⁷³ Auch leichte genetische Ursachen werden diskutiert.⁷⁴Gerade bei Jugendlichen scheint das Risiko für eine Entwicklung einer Psychose höher zu liegen.⁷⁰ ⁷⁵ ⁷⁶ Ebenso ist es biologisch Nachvollziehbar, warum Cannabis Psychosen ausbilden könnte. Schizophrenie und die psychotischen Wirkungen von Cannabis werden beide über Manipulationen an den Dopamin- und Glutamat-Regelkreisen hervorgerufen, weshalb eine Interaktion relativ plausibel ist.⁷⁷⁻⁸¹ Zwar ist aktuell noch keine direkte Verbindung hundertprozentig bestimmbar, jedoch liegt die Beweislage stark in Richtung einem direktem Zusammenhang von Cannabiskonsum und Entwicklung einer Psychose.
CBD scheint im Gegensatz antipsychotische Eigenschaften, auch gegen Schizophrenie⁶² ⁸² ⁸³, zu besitzen. Jedoch müssen diese noch genauer in weiteren klinischen Studien geprüft werden.⁸⁴⁻⁸⁷ CBD wird aber allem Anschein nach, auch in hohen Dosen, gut vertragen.⁸⁸ ⁸⁹
CANNABIS, GEHIRN UND EPILEPSIE
Anti-epileptische Wirkung von THC
Cannabis hat einige positive Effekte auf verschiedene Arten von Epilepsie. Jedoch sind die Wirkungsweisen von CBD und THC hier sehr unterschiedlich. THC vermittelt seine antikonvulsive Wirkung sehr wahrscheinlich über den CB1-Rezeptor im Gehirn⁹⁰, wohingegen die Mechanismen von CBD weniger gut verstanden sind und eine Vielzahl anderer Rezeptoren, wie GPR55 und TRPV1, diskutiert werden.⁹¹⁻⁹⁴ THC kann dadurch erregende Glutamat-Signale unterdrücken, welche eigentlich eine epileptische Erregung auslösen würde.⁹⁵⁻⁹⁷ Vermutlich flachen jedoch diese Effekte nach Toleranzentwicklung ab.⁹⁸
Anti-eplipetische Wirkung von CBD
Dies scheint einer der Gründe zu sein, warum es mehr Daten zu CBD in Bezug auf Epilepsie gibt. CBD hat sogar bessere Effekte aufzuweisen und ist mit weniger Nebenwirkungen verbunden. Sowohl bei Kindern als auch bei Erwachsenen mit therapieresistenten Epilepsien (z. B. Dravet und Lennox‐Gastaut-Syndrom) wurden, in Kombination mit anderen Medikamenten oder auch als Einzelgabe, eindeutige Erfolge in der Behandlung mit Cannabis Medikamenten erzielt.⁹⁹⁻¹⁰²
GEHIRNVERÄNDERUNGEN DURCH CANNABIS?
Veränderungen im Hippocampus
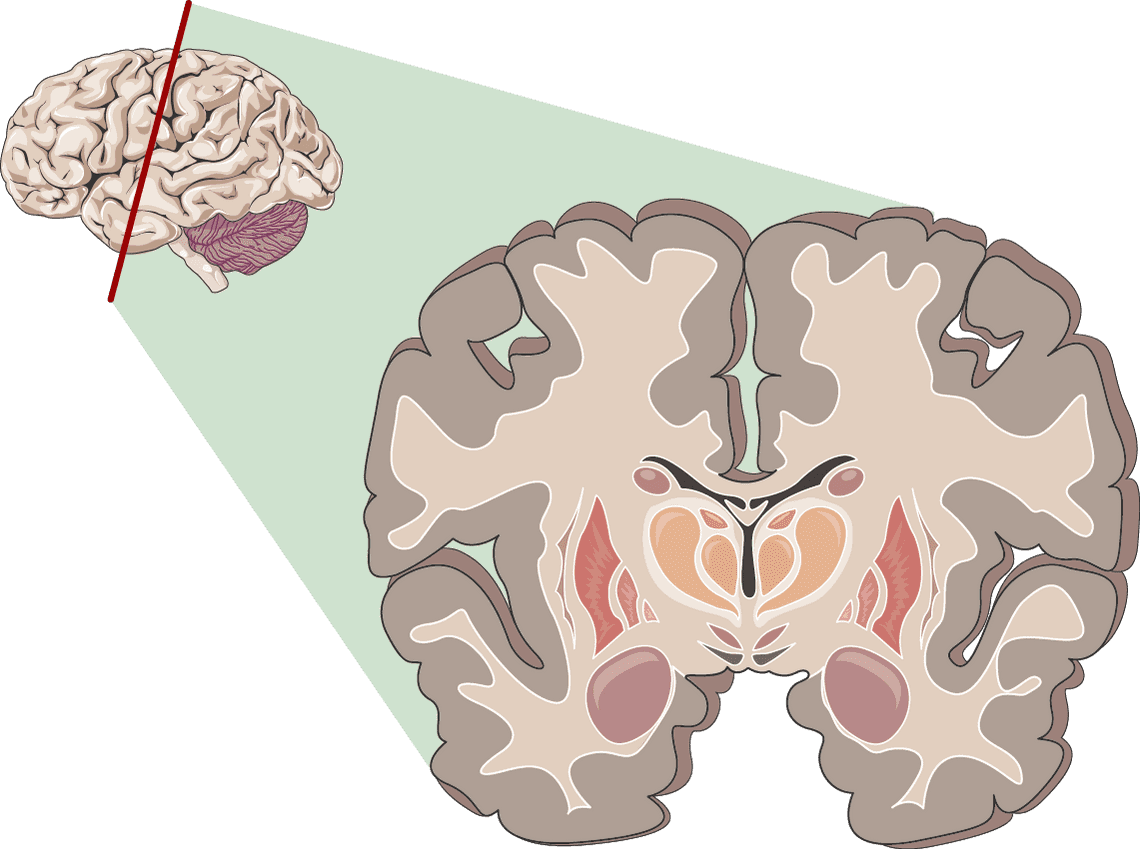
Es konnte gezeigt werden das chronischer Cannabiskonsum mit einer Verkleinerung des Orbitofrontalkortex und des Hippocampus verbunden sein kann. Diese Bereiche sind Schlüsselkomponenten der Belohnungs-, Lern- und Motivationskreisläufe und ergänzen sich daher gut mit den oben genannten Nebenwirkungen.¹⁰³
Veränderungen in weiteren Hirnarealen
Zusätzlich verringert es die Aktivierung im anterioren cingulären Cortex, der unter anderem für Wirkungen auf das Herz-Kreislaufsystem verantwortlich ist.¹⁰⁴Auch der dorsolaterale präfrontale Kortex scheint von einer verringerten Aktivierung betroffen zu sein. Aktiviert hingegen wird das Striatum.¹⁰⁴ Potentielle Folgen der Veränderungen des Gehirns durch Cannabis sind Teilweise logisch nachvollziehbar, bei anderen Veränderungen können bisher noch keine konkreten Auswirkungen ausgemacht werden.¹⁰³
Ursache oder Folge?
Des Weiteren wird immer noch stark über die Henne oder das Ei diskutiert, d.h. sind die strukturellen Veränderungen des Gehirns Vorboten für einen potentiellen chronischen Cannabisabusus oder sind sie Folgen dessen.¹⁰³ ¹⁰⁵ Auch die Frage über irreversible Schäden steht aktuell noch im Raum, da einige Studien das Verschwinden der Hirnveränderungen bei anhaltender Abstinenz, und der damit verbundenen neuronalen Erholung, beschreiben.¹⁰³ ¹⁰⁵
FOLGEN VON CANNABIS AUF DIE GEHIRNENTWICKLUNG
Gehirnveränderungen von Kindern
Die Gehirnentwicklung von Kindern und jungen Erwachsen besticht durch enorme Veränderungen der Gehirnstrukturen. Unteranderm des limbischen Systems, der weißen Hirnsubstanz, der grauen Hirnsubstanz und einer Reihe von geschlechtsspezifischen Unterschieden.¹⁰⁶ Das Endocannabinoid-System spielt hierbei eine große Rolle. Somit ist es plausibel, dass eine Exposition in dieser vulnerablen Phase Konsequenzen für die normative Reifung des Gehirns hat.¹⁰⁷⁻¹⁰⁹

Auswirkungen von Cannabis auf das entwickelnde Gehirn
Die Auswirkungen von Cannabis auf dieses stark verändernde System und die Mechanismen, die diesen Assoziationen zugrunde liegen, sind leider immer noch nicht präzise genug verstanden, um genauere Aussagen zu tätigen..¹⁰⁸ Allerdings konnte die negative Beeinflussung auf das Zurechtstutzen von ungenutzten synaptischen Verbindungen und die weiße Substanz, als potentielle Schlüsselprozesse ausgemacht werden.¹⁰⁷ Eben diese Prozesse spielen unter anderem bei der Entwicklung einer Schizophrenie oder Depression erneut eine Rolle.¹⁰⁷ ¹⁰⁹Heranwachsende Cannabiskonsumenten neigen dazu, bei Aufgaben, die Aufmerksamkeit, Gedächtnis, Verarbeitungsgeschwindigkeit, visuell-räumliche Funktionen und exekutive Funktionen¹¹⁰ erfordern, schlechtere Leistungen zu erbringen als Nichtkonsumenten.¹⁰⁶ Die Verlangens- bzw. Selbstkontrolle ist möglicherweise bei jungen Cannabiskonsumenten weniger stark ausgeprägt als bei erwachsenen Konsumenten, was wiederum zu verstärktem Konsum führen könnte.¹¹⁰
Langzeitfolgen?
Bestimmte Symptome scheinen nach Abstinenz wieder zu verschwinden. So wurde zum Beispiel eine Verbesserung der Lernfähigkeit nach Abstinenz festgestellt.¹¹¹ Dies heißt nicht das dies auch für die Allgemeinheit gilt. Welche Effekte nun wirklich reversibel sind bzw. inwieweit sie das überhaupt sind ist noch nicht genau genug erforscht.¹¹⁰ Über die Beeinflussung von Cannabis auf die Gehirnentwicklung des Kindes, während einer Schwangerschaft, kann aktuell noch keine stichhaltige Aussage getroffen werden. Jedoch gehen die Forscher davon aus, dass die vorgeburtliche Exposition den normalen Verlauf und die Mechanismen der Hirnreifung stören könnte.¹⁰⁷Zusätzlich sind Anzeichen von Lern- und Konzentrationsschwächen bei exponierten Kindern festgestellt worden.¹¹²
Tags
Rechtliches